Características del oxígeno
Ni la leche ni el pan: el truco casero que todo el mundo olvida para que las torrijas queden esponjosas de verdad
Los historiadores lloran de emoción: recuperan una de las siete maravillas del mundo en bloques de 80 toneladas
Esto que tocas todo el rato en tu casa es asqueroso: está lleno de bacterias y nunca lo limpias

El oxígeno es el elemento químico de número atómico 8 que constituye cerca de la quinta parte del aire atmosférico terrestre en su forma molecular O2. En esta forma molecular, que está compuesta por dos átomos de este elemento, el oxígeno es un gas.
El oxígeno es un elemento clave de la química orgánica, al formar parte del agua (H2O), de los óxidos, de los seres vivos y de casi todos los ácidos y sustancias orgánicas. Se trata de un gas incoloro, inodoro e insípido, que es muy reactivo y que resulta esencial para la respiración.

¿Cómo se descubrió el oxígeno?
El oxígeno no se reconoció hasta finales del Siglo XVIII. Quién primero lo preparó fue Scheele, un químico sueco, en 1772. Lo identificó como uno de los principales constituyentes del aire, y lo llamó ‘aire de fuego’ y ‘aire de vitriolo’. No obstante, a quien se considera generalmente como su descubridor es a Priestley, puesto que publicó sus resultados en 1774, mientras que Scheele retrasó su publicación hasta 1777.
En su preparación original, Priestley calentó lo que hoy se conoce como Óxido de mercurio, HgO, y observó el desprendimiento de un gas. A este gas lo denominó aire deflogistizado y observó que aumentaba la brillantez de una llama. Sin embargo, fue Lavoisier quien reconoció en el nuevo gas un elemento y lo llamó oxígeno en 1777 (del griego oxy genes, formador de ácidos).

Propiedades del oxígeno
Una de las propiedades de los elementos no metales como éste es, por ejemplo, que son malos conductores del calor y la electricidad. El oxígeno, al igual que los demás elementos no metales, no tiene lustre. Debido a su fragilidad, no se pueden aplanar para formar láminas ni estirar para convertirse en hilos.
Características físicas
El estado del oxígeno en su forma natural es gaseoso (paramagnético). Se trata de un elemento químico de aspecto incoloro que, como decíamos, pertenece al grupo de los no metales. Su número atómico es 8 y su símbolo químico es O.

Su punto de fusión es de 50,35 grados Kelvin o de -221,8 grados celsius (centígrados). Por último, señalar que su punto de ebullición es de 90,18 grados Kelvin o de -181,97 grados celsius (centígrados).
Usos y aplicaciones actuales
Soldaduras
El oxígeno se utiliza en los sopletes para soldar a temperaturas muy altas. Esta técnica es indispensable en la industria del motor, en la fabricación de maquinaria y en la aerospacial, donde se utiliza como líquido propulsor. El oxígeno se usa también en la fabricación de metales de gran pureza.
Los procesos de soldadura se clasifican según las fuentes de presión y calor utilizadas. El tipo de soldadura más adecuado para unir dos piezas de metal depende de las propiedades físicas de los metales, del uso que se le dé a la pieza y hasta de las instalaciones disponibles.
Otros usos
- El aire enriquecido con oxígeno se utiliza para fabricar acero en los hornos de hogar abierto.
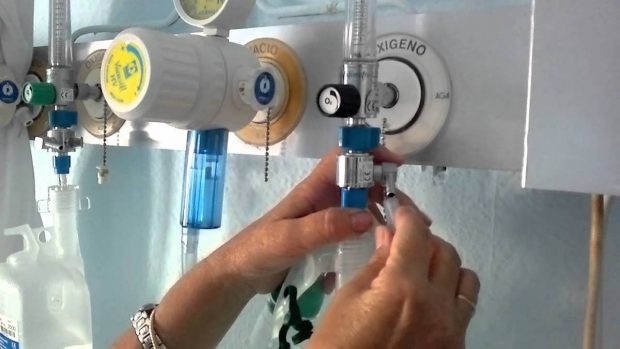
- En medicina se le administra a pacientes con problemas respiratorios.
- También a las personas que vuelan a altitudes elevadas, dado que la baja cantidad de oxígeno no permite la respiración normal.
Influencia del oxígeno sobre nuestra salud
Todo ser humano necesita oxígeno para respirar, pero como ocurre con muchas sustancias, un exceso de ello no es bueno. Si uno se expone a grandes cantidades de este elemento durante mucho tiempo, como respirar un 50-100% a presión normal durante un periodo prolongado puede provocar daños en los pulmones.

Las personas que en su trabajo sufren exposiciones frecuentes o potencialmente elevadas a oxígeno puro, deben hacerse un chequeo de funcionamiento pulmonar antes y después de desempeñar ese trabajo. Este elemento es normalmente almacenado a temperaturas muy bajas y, por lo tanto, se deben usar ropas especiales para prevenir la congelación de los tejidos corporales.















