Un GPS biológico para tratar las enfermedades hereditarias
En 1988 comenzó el primer ensayo clínico de terapia génica, aprobado para la enfermedad de Gaucher
Las dolencias genéticas se producen como consecuencia de mutaciones en la secuencia de los genes
Qué es una enfermedad genética
Fact checked
Este artículo de OkSalud ha sido verificado para garantizar la mayor precisión y veracidad posible: se incluyen, en su mayoría, estudios médicos, enlaces a medios acreditados en la temática y se menciona a instituciones académicas de investigación. Todo el contenido de OkSalud está revisado pero, si consideras que es dudoso, inexacto u obsoleto, puedes contactarnos para poder realizar las posibles modificaciones pertinentes.
Más de 300 millones de personas en el mundo padecen enfermedades genéticas. En 1988 comenzó el primer ensayo clínico de terapia génica, aprobado para la enfermedad de Gaucher, lo que abrió paso a una nueva y esperanzadora era para el tratamiento de estas dolencias.
30 años más tarde, el viaje continúa. Se han desarrollado más de 2 000 ensayos clínicos de terapia génica y en el mundo existen 36 fármacos aprobados para su comercialización.
Por el camino, la ciencia se ha encontrado con obstáculos como la toxicidad de los medicamentos, la dificultad de producirlos a gran escala y, especialmente, el desafío de llevarlos hasta el tejido afectado y al interior de la célula.
Recientemente, el diseño de una especie de GPS sintético en forma de proteína podría abrir una nueva puerta en el tratamiento de estas enfermedades.
Los retos de la terapia génica
Las dolencias genéticas se producen como consecuencia de mutaciones en la secuencia de los genes. Si estas alteraciones afectan al ADN de las células que originan los óvulos y espermatozoides, serán transmitidas a la descendencia.
Para sustituir o reparar el gen mutado, la terapia génica utiliza fragmentos cortos de ADN o ARN a modo de “parche”. Estos también se han usado para bloquear la expresión de genes y proteínas patológicos.
Aunque existen muchos ensayos en marcha, pocos de ellos llegan a funcionar en los pacientes. Actualmente, como se ha apuntado antes, apenas hay 36 fármacos aprobados por las agencias del medicamento en el mundo.
Los principales impedimentos son llegar hasta el tejido diana, atravesar la membrana que rodea la célula y penetrar en ella. De momento, una de las mejores herramientas con la que cuentan los científicos para vencer estos obstáculos son los llamados péptidos de penetración celular (CPP, por sus siglas en inglés).
A bordo de los CCP
Los CCP consisten en cadenas cortas de menos de 30 aminoácidos que pueden atravesar la membrana de las células. Algunos de ellos, como TAT y penetratina, se encuentran en organismos como virus o moscas del género Drosophila. Otros son de origen sintético.
Pueden funcionar también como vehículos, transportando fármacos, ADN, proteínas y virus a través de la membrana al interior de las células.
Dentro del organismo, la mayoría de estos CPP tienen carga positiva, lo que facilita su unión a la membrana, a modo de imán. Los mecanismos de entrada y el tipo de célula diana dependen de cada CPP, pero no alteran la membrana celular, por lo que no suelen ser tóxicos.
Hay un número creciente de ensayos clínicos en marcha con estos péptidos, aunque aún no se ha aprobado ninguno de ellos.
El caso de la distrofia muscular de Duchenne
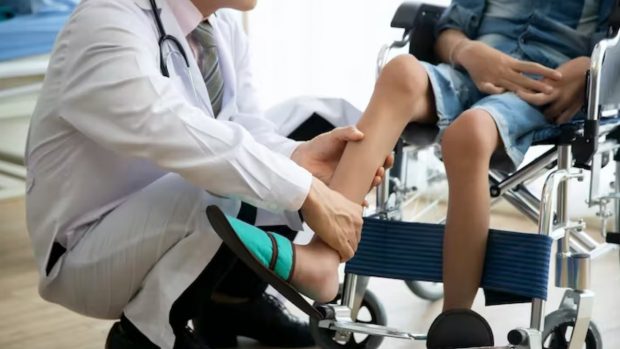
Entre las enfermedades causadas por mutaciones genéticas, y de las que se podrían beneficiar las nuevas terapias, se encuentran las distrofias musculares. Hay 30 tipos, y entre ellas destaca la distrofia muscular de Duchenne, la forma más común y grave en los niños. Afecta a a 7,1 de cada 100.000 bebés varones nacidos vivos, lo que supone 20 000 casos nuevos cada año en el mundo. La esperanza de vida de los pacientes ronda los 22 años.
Los primeros síntomas, dificultades para caminar o moverse, aparecen entre los 3 y 5 años y progresan rápidamente. Los niños necesitan una silla de ruedas a partir de los 12-15 años, y a medida que avanza la dolencia, también se hace necesario un respirador.
El origen está en la mutación del gen que permite producir la proteína distrofina, esencial para las células del músculo. La anomalía impide que la producción de distrofina o hace que se elimine rápidamente. Debido a esta carencia, el músculo se va dañando y sustituyendo por cicatrices y grasa con cada contracción.
Aunque en la mayoría de los casos la mutación es heredada, aproximadamente un 30 % ocurre espontáneamente durante el desarrollo del feto.
La distrofia muscular de Duchenne se manifiesta principalmente en varones porque el gen de la distrofina se encuentra en el cromosoma X. Las mujeres pueden portar la mutación, pero al poseer dos cromosomas X raramente sufren síntomas.
En busca de una cura
La cura para la enfermedad pasaría por reemplazar el gen, corregir la mutación o evitar esa parte del gen con el fin de que la célula recupere la producción de la proteína. Para esto se han diseñado fragmentos cortos de ADN y ARN, llamados oligonucleótidos, capaces de unirse específicamente a la zona que contiene la mutación.
El tratamiento con oligonucleótidos ha sido aprobado por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) en los pacientes de distrofia muscular de Duchenne. Sin embargo, la eficacia es limitada, sobre todo por la dificultad de hacer llegar esas moléculas a todos los músculos; especialmente al corazón y al diafragma, muy afectados por la distrofia.
Recientemente, un grupo de investigadores de la Universidad de Oxford y Cambridge ha propuesto una posible solución a este problema. Han fusionado estos oligonucleótidos con una nueva familia de CPP, especialmente diseñados –como si incorporaran un GPS– para llegar hasta el músculo y atravesar la membrana de la célula.
Los resultados muestran gran eficacia y seguridad en los ensayos con modelos animales. Esto ha facilitado la aprobación del primer ensayo clínico en seres humanos con estas moléculas híbridas, que se encuentra actualmente en curso.
De repetirse los resultados positivos en pacientes de distrofia muscular se abriría una esperanza para ellos y sus familias. Y lo que es más: utilizando distintos péptidos y fragmentos de ADN para el gen mutado, otras enfermedades genéticas podrían beneficiarse de este tratamiento en un futuro próximo.
*Este artículo fue publicado originalmente en The Conversation
**Investigadora en enfermedades neuromusculares. Profesora de Genética en Universidad de Zaragoza, Universidad de Zaragoza
Temas:
- Enfermedades
- Salud









