El indicador europeo de referencia desmonta a Mónica García: España no es líder en fármacos oncológicos
El informe analiza la disponibilidad de las nuevas terapias en 36 países, y constata que el tiempo de espera en España alcanza los 661 días

Fact checked
Este artículo de OkSalud ha sido verificado para garantizar la mayor precisión y veracidad posible: se incluyen, en su mayoría, estudios médicos, enlaces a medios acreditados en la temática y se menciona a instituciones académicas de investigación. Todo el contenido de OkSalud está revisado pero, si consideras que es dudoso, inexacto u obsoleto, puedes contactarnos para poder realizar las posibles modificaciones pertinentes.
La ministra de Sanidad, Mónica García, ha declarado que, a pesar de «los bulos del PP», España se encuentra entre los países de Europa «con mayor acceso a medicamentos oncológicos». Sin embargo, esta afirmación resulta claramente incorrecta cuando se comparan los datos de informes internacionales, como el Indicador de Acceso a Terapias Innovadoras en Europa 2023 (WAIT Indicator), uno de los más prestigiosos a nivel mundial, así como los estudios de sociedades científicas.
En este contexto, la Federación Europea de la Industria Farmacéutica (EFPIA) publicó el informe WAIT sobre acceso a terapias innovadoras en Europa y en el documento se muestra que en España están disponibles el 58% de las terapias a las que ha dado luz verde la Unión Europa; el 52% de ellas, están financiadas en nuestro país con restricciones y el tiempo de espera es de 22 meses. España sigue a la zaga de Alemania, Francia, Italia y Reino Unido.
Por otro lado, la titular de Sanidad ha asegurado que España se encuentra entre los países con mayor acceso a medicamentos oncológicos en relación con su Producto Interno Bruto (PIB), centrando su argumento en la economía del país. Sin embargo, la realidad es que la disponibilidad de tratamientos contra el cáncer en España es una de las más bajas de Europa, como ha quedado patente recientemente con la falta de disponibilidad de un tratamiento para la leucemia linfoblástica aguda (LLA).
Lo cierto es que la ministra de Sanidad, Mónica García, ha dejado de nuevo desprotegidos a los pacientes con cáncer, esta vez a los niños afectados por leucemia linfoblástica aguda (LLA). En lugar de garantizar el acceso universal al anticuerpo monoclonal blinatumomab, sólo ha permitido su uso compasivo, lo que implica que su administración queda limitada a casos específicos y requiere la aprobación individualizada de cada centro hospitalario. Esta medida genera una grave inequidad en el acceso al tratamiento, dejando a muchos pacientes en una situación de vulnerabilidad.
A pesar de los bulos del PP, España está entre los países con mayor acceso a medicamentos oncológicos en relación con su PIB y lidera Europa en ensayos clínicos.
Mientras recortaban en sanidad y cedían ante el pulso de las farmacéuticas, trabajamos por todo lo que que falta: pic.twitter.com/wuimZdK5RL
— Mónica García (@Monica_Garcia_G) February 11, 2025
Cáncer de mama
El pasado mes de agosto, un grupo de mujeres pacientes con cáncer de mama metastásico entregaron al Ministerio de Sanidad cerca de 90.000 firmas recogidas a través de la plataforma Change.org para solicitar que el Sistema Nacional de Salud (SNS) financiara los fármacos Enhertu y Trodelvy, porque tampoco había disponibilidad de ellos.
El cáncer de mama metastásico sigue siendo hoy en día, a pesar de los avances de la investigación y del esfuerzo diario de muchos profesionales, la primera causa de muerte en mujeres entre 35 y 50 años. Se calcula que el pasado año fallecieron 6.621 personas como consecuencia de esta patología, muchas mujeres, y algunos hombres.
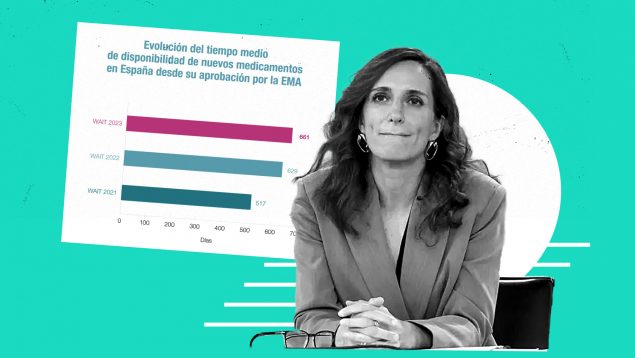
Pero volviendo al informe internacional WAIT con un gran reconocimiento internacional y con pocas dudas sobre los datos que muestra, se señala que el tiempo medio de demora alcanza ya los 22 meses desde la autorización europea. Este plazo, de 661 días, es mayor que en el informe anterior, de 629 días.
Si en lugar de tener en cuenta la fecha de la autorización europea se contabiliza el tiempo a partir del momento en el que la compañía manifiesta su interés en comercializar en España (obtención del código nacional), el tiempo se reduce hasta los 551 días. De todas formas, ese plazo también supera con creces los 180 días establecidos en la legislación europea y nacional.
Las diferencias entre los países llegan a ser del 84% entre el país con mayor disponibilidad (Alemania, con un 88%) y con menor acceso (Malta, con un 4%).
El hecho de que España se presenta como líder en Europa en cuanto a ensayos clínicos tiene sus contradicciones. Si bien es cierto que nuestro país participa activamente en esos estudios, muchos de los países europeos con un mayor poder adquisitivo y un sistema sanitario más eficiente ofrece un acceso más rápido y menos burocrático a los ensayos clínicos y medicamentos avanzados. Además, la disponibilidad de tratamientos experimentales en algunos países de la UE puede ser mucho más rápida y eficaz.
Temas:
- Mónica García
- Oncología