Las bio impresoras 3D ya crean tejidos vivos que se pueden trasplantar
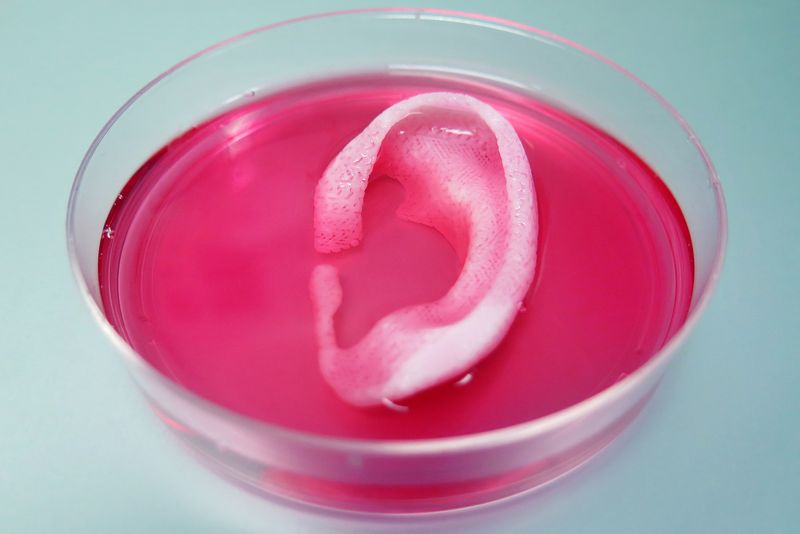
Desde hace ya algunos años, uno de los terrenos en los que las impresoras 3D están siendo de una extraordinaria utilidad es el de la medicina, y se emplean ya para imprimir desde férulas o “escayolas impresas” para recuperar fracturas, hasta prótesis y otros elementos que hacen más fácil recuperarse de una lesión o ayudar a sustituir parte de un hueso o articulación. Sin embargo, por fin parece que se está alcanzando la fabricación con células vivas y bio elementos con impresoras 3D que están consiguiendo crear órganos y tejido que se puede transplantar ya en un ser vivo. La técnica, como puedes imaginarte, es mucho más compleja que sencillamente fundir un filamento plástico como hacen las impresoras 3D convencionales, pero con esta bio impresora se han conseguido crear estructuras musculares, óseas y cartílago que se han podido reimplantar en roedores con éxito y se han mantenido estables en el tiempo.
Estas técnicas prometen una nueva era de auto transplantes ya que usando células del propio paciente se pueden reconstruir huesos y cartílagos para personas que los hayan perdido en un accidente. Imagina lo que puede suponer, para alguien que ha sufrido grandes heridas en su rostro, recuperar una oreja o la nariz, o para quien ha tenido una severa fractura poder recuperar por completo un hueso. Según informa The Verge, las nuevas bio impresoras son capaces desde hace algún tiempo de crear tejidos de todo tipo, desde tejido renal para para usarlo en pruebas de medicamentos hasta tejido nervioso, pero se trataba de estructuras demasiado simples, inestables o demasiado pequeñas para ser trasplantadas en humanos. Por eso, el nuevo avance que describe la publicación Nature Biotechnology es un hito, ya que por primera vez se puede crear tejido funcional y vascularizado que puede ser utilizado para aplicaciones clínicas.

La bioimpresora funciona creando cuidadosas capas de un gel que contiene células vivas y materiales biodegradables similares a un plástico. Posteriormente, la impresora añade una cubierta exterior de un polímero que ayuda a que la estructura se mantenga estable durante la implantación. El proceso de fabricación ha sido además afinado para qe las células se mantengan vivas hasta el trasplante y una vez en el tejido vivo, los materiales biodegradables van desapareciendo y la “prótesis” se va convirtiendo en parte del tejido del receptor.
Para probar los implantes, los científicos los han introducido bajo la piel de ratones y ratas y las estructuras parecen muy prometedoras: dos meses después las orejas implantadas en ratones mantienen su forma y se ha creado verdadero tejido cartilaginoso. En el caso de los músculos, los investigadores han encontrado que dos meses después del implante éste había provocado la formación de tejido nervioso en las ratas, y en el caso del tejido óseo, los implantes “impresos” con células madre humanas e implantados en ratas, provocaron la formación de vasos sanguíneos observables tras cinco meses.
No obstante, parece que de todos los tipos de tejido, el cartílago es el que más posibilidades tiene de aplicarse en un futuro próximo en usos clínicos ya que no requiere de un sistema de vasos sanguíneos como el de los músculos o los huesos. Así, lo que hasta hace muy poco parecía ciencia ficción puede ser pronto una realidad y miles de personas se podrán beneficiar de estos implantes, y aunque de momento sea quizá para cosas “sencillas” como reconstruir una oreja, para quienes han sufrido un accidente puede ser un auténtico milagro.

















