Niels Bohr: vida, teoría atómica y contribuciones a la física
Niels Bohr: vida, teoría atómica y principales contribuciones de uno de los padres de la física moderna.
Teoría y modelo atómico de Lewis
Átomo de Dalton
Átomo de Rutherford


Niels Bohr fue una de las grandes figuras de la física del siglo XX. Transformó la comprensión del mundo atómico y sentó las bases de la mecánica cuántica. Su modelo revolucionó la ciencia para siempre.
Biografía de Niels Bohr
Niels Henrik David Bohr nació el 7 de octubre de 1885 en Copenhague, Dinamarca, en una familia intelectual. Su padre, Christian Bohr, era profesor de fisiología, y su madre, Ellen Adler, provenía de una prominente familia judía danesa.
Niels Bohr estudió en la Universidad de Copenhague, donde obtuvo su maestría en 1909 y su doctorado en 1911. Ese año viajó a Inglaterra para trabajar con J.J. Thomson en Cambridge y luego con Ernest Rutherford en Manchester. En 1913 regresó a Dinamarca y publicó su modelo atómico, un hito en la física.
Durante la Segunda Guerra Mundial, Bohr huyó de la ocupación nazi en1943, primero a Suecia y luego a Estados Unidos. Allí participó en el Proyecto Manhattan. Tras la guerra, abogó por el uso pacífico de la energía nuclear. Bohr murió el 18 de noviembre de 1962 en Copenhague.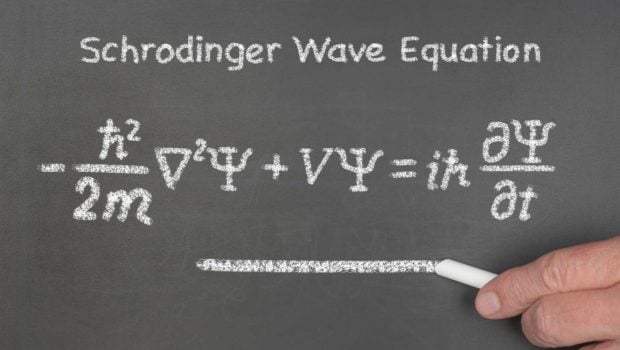
Modelo atómico y teoría de Bohr
Basándose en el modelo de Rutherford, Bohr introdujo ideas revolucionarias para resolver algunas inconsistencias que persistían. Por ejemplo, por qué los electrones no caían al núcleo por la atracción electrostática.
El modelo de Bohr postula que:
- Los electrones tienen órbitas circulares estables alrededor del núcleo, sin emitir ni absorber energía.
- Tales órbitas tienen niveles de energía discretos, cuantificados y determinados por números cuánticos.
- Cuando un electrón salta de una órbita de mayor energía a una de menor, emite un fotón con una energía igual a la diferencia entre los niveles.
- Inversamente, un electrón puede absorber un fotón para ascender a una órbita superior.
Este modelo sentó las bases de la mecánica cuántica. Después fue superado por teorías más avanzadas, pero fue un pilar de la física atómica.
La salida al dilema
Bohr encontró una salida a este dilema recurriendo a una idea que en ese momento parecía casi extravagante: la cuantización de la energía. Inspirado en los trabajos de Max Planck y Albert Einstein, propuso en 1913 que los electrones no podían ocupar cualquier órbita, sino únicamente determinadas órbitas estables, llamadas “niveles de energía”. Mientras permanecieran allí, no irradiaban energía. Solo cuando un electrón saltaba de un nivel a otro se absorbía o se emitía un cuanto de energía, en forma de radiación electromagnética.
Este planteamiento, que en un inicio parecía osado, resultó tener una consecuencia maravillosa: explicaba con precisión las líneas del espectro del hidrógeno, un rompecabezas que la física clásica no lograba resolver. Cada línea correspondía a un salto electrónico concreto. Por primera vez se podía relacionar la estructura del átomo con un fenómeno experimental y medible.
Claro que el modelo de Bohr no era perfecto. Funcionaba muy bien con el hidrógeno, pero al intentar aplicarlo a átomos más complejos pronto mostraba sus limitaciones. Aun así, su importancia fue enorme: abrió el camino a la mecánica cuántica, una teoría mucho más completa desarrollada después por Schrödinger, Heisenberg y otros, donde los electrones ya no se conciben como partículas en órbitas fijas, sino como ondas de probabilidad.
Contribuciones a la mecánica cuántica
Bohr contribuyó al desarrollo de la mecánica cuántica, no solo a través de su modelo atómico, sino también mediante conceptos filosóficos y teóricos. En la década de 1920, colaboró con físicos como Werner Heisenberg y Max Born en el Instituto de Copenhague. Así surgió la “Interpretación de Copenhague” de la mecánica cuántica.
Esta interpretación, que sigue siendo influyente, establece que:
- Las partículas cuánticas no tienen propiedades definidas (como posición o momento) hasta que se miden.
- El acto de medir colapsa la función de onda, determinando el estado de la partícula.
- La dualidad onda-partícula implica que los fenómenos cuánticos pueden exhibir comportamientos de onda o partícula dependiendo del experimento.
Bohr también introdujo el principio de complementariedad. Este sostiene que ciertos fenómenos cuánticos, como la luz o los electrones, pueden describirse como ondas o partículas, pero no ambas simultáneamente.
Participación en proyectos científicos internacionales
Durante la Segunda Guerra Mundial, Bohr participó en el Proyecto Manhattan y contribuyó al desarrollo de la bomba atómica. Después, abogó por la transparencia en la investigación nuclear para evitar una carrera armamentística.
Fundó el Instituto de Física Teórica en Copenhague, que se convirtió en un epicentro para físicos como Heisenberg, Pauli y Dirac. También participó en la creación del CERN en 1954, el laboratorio europeo que hoy alberga el Gran Colisionador de Hadrones.
Bohr desempeñó un importante rol en la reconstrucción científica de Europa tras la guerra.
Impacto y legado de Bohr en la física moderna
El legado de Niels Bohr es inmenso. Su modelo atómico fue el precursor de la mecánica cuántica, que permitió el desarrollo de tecnologías como los semiconductores, los láseres y la informática cuántica.
La Interpretación de Copenhague sigue siendo el marco dominante para entender los fenómenos cuánticos. El Instituto Niels Bohr en Copenhague es un centro de excelencia que atrae a investigadores de todo el mundo.
Bohr recibió el Premio Nobel de Física en 1922. También fue galardonado con la Medalla Copley (1938) y la Orden del Elefante de Dinamarca, un raro premio para un científico.
Conclusión
En definitiva, el modelo atómico de Bohr marcó un antes y un después. Aunque fue superado en su forma más simple, abrió la puerta a una comprensión moderna de la materia. Su propuesta nos recuerda que incluso una idea arriesgada, cuando logra explicar lo que otros modelos no pueden, puede cambiar el rumbo de la ciencia para siempre.
Lecturas recomendadas
Temas:
- Científicos









